相互作用
每当大分子由于接近另一个大分子而改变其行为或性质时,相互作用就存在它们之间。
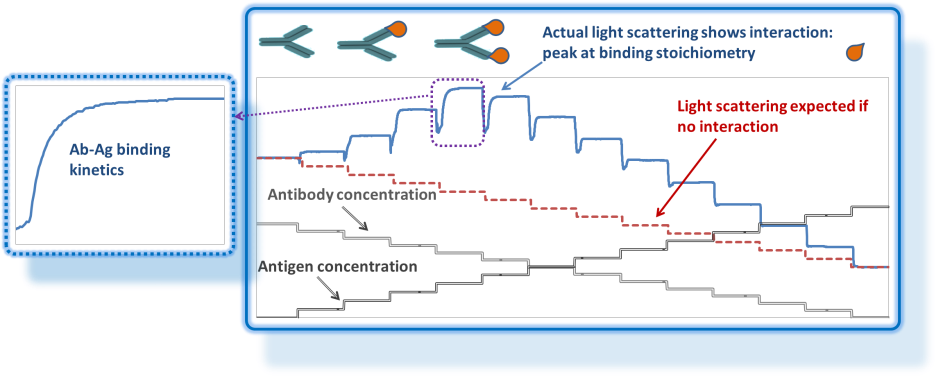
可逆络合物 的形成是由于络合物和其单体之间产生了动态平衡的非共价相互作用。这种平衡是依赖于浓度的,所以像SEC-MALS这样的分馏技术---稀释程度会随时间增加---不适合于可逆络合物的完整和严格的表征。组成梯度光散射(CG-MALS)是研究可逆络合物最有用的技术之一(CG-MALS)。
CG-MALS可表征自缔合和异缔合。
生物分子相互作用(特异性)
蛋白质、核酸、肽和其他生物大分子之间的相互作用是生物学、生理学和医学的核心,它普遍存在于所有生命形式中,是任何涉及生物分子的研究或开发计划的核心。光散射技术通过一个直接的窗口帮助您了解摩尔质量和尺寸,这是一种独特而强大的方法,可以分析:
- 蛋白质与蛋白质或蛋白质与寡核苷酸的结合,比如酶抑制剂或抗体-抗原复合物
- 许多酶活性中心的自然齐聚
- 蛋白质或淀粉样β纤维的缔合、自组装或离解动力学
CG-MALS擅长分析多蛋白复合体。
MALS是一种科学严谨的测定溶液中大分子重量平均摩尔质量的技术。如相互作用理论所述,摩尔质量作为浓度或组成函数的分析直接和直观地导致结合亲和力的测定(通常作为平衡离解常数KD)和 绝对分子化学计量学。
该分析通过 CG-MALS 进行,CG-MALS 结合了优化用于光散射测量的成分梯度制备装置 Calypso®和 MALS 检测器(如DAWN®和浓度检测器)。CALYPSO™ 软件不仅可以控制合成梯度的制备和传递,还可以从交互的角度获取和分析MALS数据。
CALYPSO 软件提供了一组无与伦比的关联模型,可以灵活地描述常见的和不寻常的复合物,所有这些物质都可以在自然界中找到。
生物分子相互作用(非特异性)
在大分子浓度平均为 300 ~ 400mg/mL的细胞环境中,蛋白质、寡核苷酸和其他生物大分子自然地相互靠近。分子间间距较小意味着较弱的非特异性相互作用可能对分子的行为产生重大影响,并调节其生物功能。由于大多数结合研究都是在纯化和稀释的溶液中进行的,因此对这种“分子拥挤效应”引起的特定结合行为和其他功能的改变了解甚少。非特异性蛋白质-蛋白质的相互作用在诸如单克隆抗体和其他生物药物等生物治疗药物的制备中也引起了人们的兴趣。
光散射提供了描述大分子中非特异性相互作用的最流行和最通用的方法:
- 动态光散射(DLS)在胶体稳定性的高通量筛选中具有重要的应用价值。DynaPro® Plate Reader通过扩散相互作用参数kD测量生物大分子的相互扩散系数Dm ,以评估胶体稳定性。
- CG-MALS 通过第二维里系数A2测量非特异性相互作用。Calypso 可编程为根据缓冲液的组成自动测量A2,或在一种方法中测量三个值:两种不同大分子的A2,和指定的两种分子之间相互作用的交叉维里系数A11。
- 非特异性蛋白质相互作用中最常见的两个现象是硬核排斥和电荷排斥。硬核斥力的大小可由流体力学半径计算,由 DLS 测量,而电泳光散射(ELS)决定净分子电荷。这些值在Mobius™中同时测量。 从总相互作用中减去硬核和电荷相互作用后,剩余的量量化了导致胶体不稳定的吸引组分。
- 在部分 Wyatt 旗下产品中,仅使用微量样品体积就可同时分析A2和kD。使用比色皿的DynaPro NanoStar®在单独的检测通道中测量 DLS 和 90° 静态光散射(SLS)。同样的测量也可以在 MALS 中进行,如配备WyattQELS™ DLS module和一个microCuvette / Microbatch Kit的DAWN 或 miniDAWN®。
- 高浓度下的相互作用分析是相当困难和复杂的。多亏了来自于美国国立卫生研究院(NIH)的Dr. Allen P. Minton1首创的理论发展,他提出 CG-MALS 是开展和分析此类研究的极少数技术之一。该理论的一个变形实验在 CALYPSO 软件中实现,用于自动或手动浓度梯度MALS实验。
1 Minton, A. P. Static light scattering from concentrated protein solutions, I: General theory for protein mixtures and application to self-associating proteins. Biophys Journal 2007, 93, 1321–1328.
应用文摘
部分文献
Attri, A. K.; Fernández, C.; Minton, A. P. Self-association of Zn-insulin at neutral pH: investigation by concentration gradient static and dynamic light scattering. Biophys. Chem. 2010, 148, 23-27.
Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. In Encyclopedia of Life Sciences; Wiley: 2001.
Halling, D. B.; Kenrick, S. A.; Riggs, A. F.; Aldrich, R. W. Calcium-dependent stoichiometries of the KCa2.2 (SK) intracellular domain/calmodulin complex in solution. J. Gen. Physiol. 2014, 143, 231-252.
Monterroso, B.; Alfonso, C.; Zorilla, S.; Rivas, G. Combined analytical ultracentrifugation, light scattering and fluorescence spectroscopy studies on the functional associations of the bacterial division FtsZ protein. Methods 2013, 59, 349-362.
Some, D. Light scattering based analysis of biomolecular interactions. Biophys. Rev. 2013, 5, 147-158.
测量相互作用的相关仪器
MALS

DAWN® - 最灵敏的MALS探测器。配备18个角度的探测器,用以确定 200 Da ~ 1 GDa 摩尔质量和10 ~ 500 nm 半径的分子。
- 标准选项:常温型
- 制冷/加热型:-15 ~ 150 ℃
- 超高温型:20 ℃ ~ 210 ℃
DAWN提供了处理荧光样品的特殊信号:荧光屏蔽滤光片和 785nm 的红外激光。
miniDAWN® - 3角度光散射探测器,用以测定 200 Da ~ 10 MDa 摩尔质量和10 ~ 50 nm 半径的分子(仅限环境温度)。
DynaPro® NanoStar® - 检测时样品消耗体积低至1.25 µL,温度控制范围从 -15°C ~ +150°C,NanoStar 超越了传统的基于比色皿的 DLS 仪器。它提供了一个与 DLS 检测系统平行的优化静态光散射检测器,以确定绝对的摩尔质量。
动态光散射检测器

CALYPSO® 软件不分析 DLS 数据,但可以通过 Wyatt 的 ASTRA® 软件设置为触发 DLS 数据采集。
WyattQELS™ - 一个动态光散射(DLS)模块,集成到 DAWN 或 miniDAWN MALS 探测器中,在相同的散射体积内提供同步的DLS测量。
DynaPro® NanoStar® II - 样品体积小至2 µL,温度范围可控制在-10°C至+120°C之间,NanoStar超越了传统的基于比色皿的DLS仪器:它提供了一个优化的静态光散射检测器(与DLS检测系统并行),可以与 CALYPSO 软件一起使用,在很少的样品下进行 CG-MALS 实验。NanoStar 通过在 Wyatt MALS 探测器中安装光纤,实现了在线 DLS 探测的双重功能。
DynaPro® Plate Reader - 唯一一种可在标准96、384或1536多孔板上现场测量尺寸和摩尔质量的DLS和SLS的商用仪器。可直接测量第二维里系数A2和扩散相互作用参数kD。温度控制在4°C至85°C之间。
软件
CALYPSO™ - CALYPSO 软件协调生物分子相互作用的 CG-MALS 分析,控制样品制备和递送,数据采集和数据分析。提供可用于确定大分子相互作用的亲和力和绝对分子化学计量学的最广泛的关联模型套件,包括蛋白质-蛋白质结合、适体和肽或蛋白质的结合等,以及反应动力学的一阶分析。