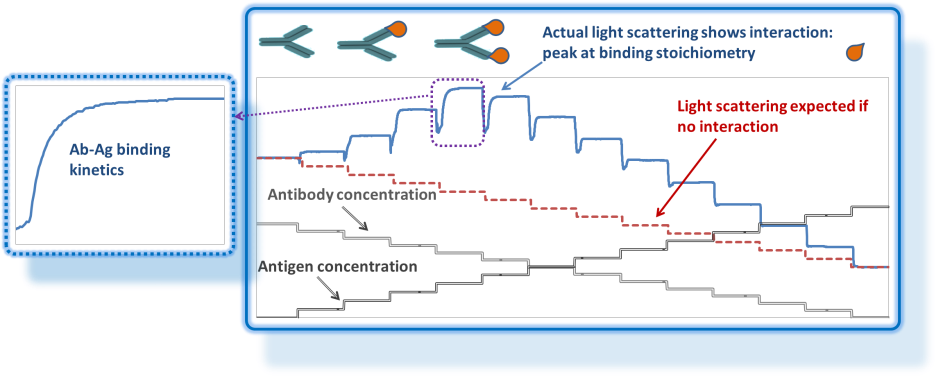
Interaktionen
Biomolekulare Wechselwirkungen sind der Schlüssel zum Verständnis einer Vielzahl von Phänomenen. Sie reichen von Struktur-Eigenschafts-Beziehungen und biotherapeutischer Aktivität bis hin zu Stabilität und Aggregation.
Einführung
Wann immer Makromoleküle ihr Verhalten oder ihre Eigenschaften als Folge der Nähe zu einem anderen Makromolekül ändern, sind Wechselwirkungen im Spiel.
Reversible Komplexe werden als Ergebnis nicht-kovalenter Wechselwirkungen gebildet, die ein dynamisches Gleichgewicht zwischen Komplexen und konstituierenden Monomeren herstellen. Dieses Gleichgewicht ist konzentrationsabhängig, so dass eine Fraktionierungstechnik wie SEC-MALS mit der damit einhergehenden zeitabhängigen Verdünnung für eine vollständige und präzise Charakterisierung reversibler Komplexe nicht geeignet ist. Eine der nützlichsten Techniken zur Untersuchung reversibler Komplexe ist die Composition-Gradient-Lichtstreuung (CG-MALS).
CG-MALS charakterisiert Selbst- und Hetero-Assoziation.
Nicht-kovalente Wechselwirkungen fallen im Allgemeinen in zwei Klassen:
- Spezifische Interaktionen – die zur Bildung von stöchiometrisch definierten Komplexen führen wie z. B. Protein-Ligand-Komplexe.
- Nicht-spezifische Interaktionen – sind auf „hard-core“ Abstoßung, elektrostatische Abstoßung und/oder Anziehung, schwache hydrophobe Anziehung, van-der-Waals-Potentiale usw. zurückzuführen. Der Nettoeffekt dieser Wechselwirkungen kann abstoßend oder anziehend sein. Während die nicht-spezifischen Interaktionen zur Bildung von Komplexen oder locker gebundenen Aggregaten führen können, weisen diese typischerweise keine definierte Stöchiometrie oder einen spezifischen oligomeren Zustand auf.
CG-MALS ist in der Lage, sowohl spezifische als auch unspezifische Wechselwirkungen zu charakterisieren, um das Ausmaß der Wechselwirkung und falls zutreffend die wahre molekulare Stöchiometrie der resultierenden Komplexe und Oligomere zu bestimmen. Die Dynamische Lichtstreuung (DLS) ist zwar nicht so empfindlich, trotzdem kann man durch ein Hochdurchsatz-Screening in Mikrotiterplatten Wechselwirkungen und deren Abhängigkeit von Pufferbedingungen untersuchen.
Spezifische Interaktionen
Die Wechselwirkungen zwischen Proteinen, Nukleinsäuren, Peptiden und anderen Biomakromolekülen sind in allen Lebensformen allgegenwärtig und stehen im Mittelpunkt jedes Forschungs- und Entwicklungsprogramms, das sich mit Biomolekülen befasst. Sie bilden das Herzstück der Biologie, Physiologie und Medizin. Durch die Möglichkeit, molare Masse und Größe präzise zu messen, bietet die Lichtstreuung einen einzigartigen und leistungsstarken Analyseansatz:
- Protein-Protein- oder Protein-Oligonukleotid-Bindung, einschließlich Enzym-Inhibitor- oder Antikörper-Antigen-Komplexe
- native Oligomerisierung, die für die Aktivität vieler Enzyme von zentraler Bedeutung ist
- Kinetik der Assoziation und Selbstassemblierung oder Dissoziation von Protein-Assemblierungen bzw. Amyloid-Beta-Fibrillen
CG-MALS eignet sich hervorragend für die Analyse von Multi-Protein-Assemblierungen.
MALS ist eine wissenschaftlich strenge Methode, die auf der direkten Messung von physikalischen Parametern beruht und der Bestimmung der gewichtsmittleren molaren Masse von Makromolekülen in Lösung dient. Wie in der Theorie der Wechselwirkungen beschrieben, führt die Analyse der molaren Masse als Funktion der Konzentration oder Zusammensetzung direkt und intuitiv zur Bestimmung der Bindungsaffinität, die normalerweise als Gleichgewichtsdissoziationskonstante KD) ausgedrückt wird und der absoluten molekularen Stöchiometrie.
Diese Analyse wird mittels CG-MALS durchgeführt. Dabei wird eine für Lichtstreumessungen optimiertes präparatives Gerät mit Zusammensetzungsgradienten, das Calypso®, mit einem MALS-Detektor wie dem DAWN® und einem Konzentrationsdetektor kombiniert. Die CALYPSO™-Software steuert die Vorbereitung und Zuführung des Zusammensetzungsgradienten. Zusätzlich erfasst und analysiert sie die MALS-Daten in Bezug auf Wechselwirkungen.
Die CALYPSO-Software bietet eine unvergleichliche Auswahl von Assoziationsmodellen mit der Flexibilität, sowohl häufige als auch ungewöhnliche Komplexe zu beschreiben, die alle in der Natur vorkommen können.
Nicht-spezifische Interaktionen
Die zelluläre Umgebung mit einer durchschnittlichen makromolekularen Konzentration von 300 - 400 mg/mL zwingt Proteine, Oligonukleotide und andere Biomakromoleküle auf natürliche Weise in enge, räumliche Nähe zueinander. Die kurzen intermolekularen Abstände bedeuten, dass schwache, nicht-spezifische Wechselwirkungen einen signifikanten Einfluss auf das Verhalten der Moleküle haben und ihre biologische Funktion modulieren können. Änderungen des spezifischen Bindungsverhaltens und anderer Funktionalitäten, die sich aus diesem „molekularen Verdrängungseffekt“ ergeben, sind nur unzureichend verstanden, da die meisten Bindungsstudien mit gereinigten und verdünnten Proben durchgeführt werden. Unspezifische Protein-Protein-Wechselwirkungen sind auch bei der Formulierung von Biotherapeutika wie monoklonalen Antikörpern und anderen biologischen Medikamenten von Interesse.
Die Lichtstreuung bietet die beliebtesten und vielseitigsten Methoden zur Charakterisierung unspezifischer Wechselwirkungen in Makromolekülen:
- Für das Hochdurchsatz-Screening der kolloidalen Stabilität hat sich die dynamische Lichtstreuung (DLS) als sehr nützlich erwiesen. Der DynaPro® Plate Reader misst den wechselseitigen Diffusionskoeffizienten Dm von biotherapeutischen Makromolekülen, um die kolloidale Stabilität über den Diffusionsinteraktionsparameter kD zu beurteilen.
- CG-MALS misst unspezifische Wechselwirkungen über den zweiten Virialkoeffizienten A2. Das Calypso kann so programmiert werden, dass es A2 automatisch als Funktion der Pufferzusammensetzung misst oder eine Methode ausführt, die drei Werte misst: den A2 von zwei verschiedenen Makromolekülen und den Kreuzvirialkoeffizienten A11, der die Wechselwirkungen zwischen den beiden Molekülen beschreibt.
- Die beiden häufigsten Faktoren bei unspezifischen Protein-Protein-Wechselwirkungen sind die „Hard-Core“-Abstoßung und die Ladungs-Ladungs-Abstoßung. Die Größe der „Hard-Core“-Abstoßung kann aus dem hydrodynamischen Radius, gemessen mit DLS, berechnet werden, während die elektrophoretische Lichtstreuung (ELS) die Nettomolekülladung bestimmt. Diese Werte werden gleichzeitig im Mobius™ gemessen. Nach Abzug der „Hard Core“- und Ladungs-Ladungs-Wechselwirkung von der Gesamtwechselwirkung quantifiziert die verbleibende Größe die attraktiven Komponenten, die zu kolloidaler Instabilität führen.
- Die gleichzeitige Analyse von A2 und kD in kleinen Volumina wird durch mehrere Wyatt-Detektoren ermöglicht. Das küvettenbasierte DynaPro NanoStar® misst DLS und 90° statische Lichtstreuung (SLS) in separaten, optimierten Detektionskanälen. Die gleichen Messungen können in einem MALS-Detektor wie dem DAWN oder miniDAWN® durchgeführt werden, der mit einem WyattQELS™ DLS module und einer Mikroküvette oder einem Mikrobatch-Kit ausgestattet ist.
- Die Analyse von Wechselwirkungen bei hohen Konzentrationen kann recht unzugänglich und kompliziert sein. Dank der theoretischen Entwicklungen, die von Dr. Allen P. Minton1 vom NIH vorangetrieben wurden, ist CG-MALS eine der wenigen Techniken, die für die Durchführung und Analyse solcher Studien zur Verfügung stehen. Eine Variante dieser Theorie ist in der CALYPSO-Software zur Verwendung in automatisierten oder manuellen Konzentrationsgradienten-MALS-Experimenten implementiert.
1 Minton, A. P. Statische Lichtstreuung aus konzentrierten Proteinlösungen, I: Allgemeine Theorie für Proteinmischungen und Anwendung auf selbstassoziierende Proteine. Biophys Journal 2007, 93, 1321–1328.
Ressourcen
Application Notes
Ausgewählte Literatur
Attri, A. K.; Fernández, C.; Minton, A. P. Self-association of Zn-insulin at neutral pH: investigation by concentration gradient static and dynamic light scattering. Biophys. Chem. 2010, 148, 23-27.
Folta-Stogniew, E. J. Macromolecular Interactions: Light Scattering. In Encyclopedia of Life Sciences; Wiley: 2001.
Halling, D. B.; Kenrick, S. A.; Riggs, A. F.; Aldrich, R. W. Calcium-dependent stoichiometries of the KCa2.2 (SK) intracellular domain/calmodulin complex in solution. J. Gen. Physiol. 2014, 143, 231-252.
Monterroso, B.; Alfonso, C.; Zorilla, S.; Rivas, G. Combined analytical ultracentrifugation, light scattering and fluorescence spectroscopy studies on the functional associations of the bacterial division FtsZ protein. Methods 2013, 59, 349-362.
Some, D. Light scattering based analysis of biomolecular interactions. Biophys. Rev. 2013, 5, 147-158.
Instrumente für die Messung von Interaktionen
Composition-Gradient-System

Calypso® - Composition-Gradient-Präparationssystem + Software zur Durchführung und Auswertung von CG-MALS-Wechselwirkungsanalysen. Erfordert einen MALS-Detektor.
MALS-Detektoren

DAWN® - Der empfindlichste MALS-Detektor, der auf dem Markt erhältlich ist. Beinhaltet Detektoren auf 18 Winkeln zur Bestimmung von molaren Massen von 200 Da bis 1 GDa und Radien von 10 - 500 nm.
- Standardoption: keine Temperaturkontrolle
- Heiz/Kühl-Option: -15 °C bis +150 °C
- Hochtemperatur-Option: Umgebungstemperatur bis +210 °C
Das DAWN bietet spezielle Optionen zum Umgang mit fluoreszierenden Proben: Fluoreszenzsperrfilter und einen Infrarot-Laser mit 785 nm.
miniDAWN® - Die zweithöchste Empfindlichkeit nach dem DAWN. Beinhaltet Detektoren in 3 Winkeln zur Bestimmung von molaren Massen von 200 Da bis 10 MDa und Radien von 10 - 50 nm. Keine Temperaturkontrolle.
DynaPro® NanoStar® - Mit einem Probenvolumen von nur 1,25 µL und einer Temperaturregelung von -15 °C bis +150 °C geht das NanoStar über die traditionellen küvettenbasierten DLS-Geräte hinaus: Es bietet einen optimierten Statischen Lichtstreudetektor (parallel zum DLS-Detektionssystem), der mit der CALYPSO-Software verwendet werden kann, um CG-MALS-Experimente mit sehr wenig Probe durchzuführen. Die Proben müssen manuell vorbereitet werden, ohne den Vorteil der Automatisierung des Calypso.
Dynamische Lichtstreuungsdetektoren

Die CALYPSO™-Software analysiert keine DLS-Daten, kann aber so eingestellt werden, dass sie die DLS-Datenerfassung durch die ASTRA®-Software von Wyatt auslöst.
WyattQELS™ - Ein Modul für Dynamische Lichtstreuung (DLS), das in einen DAWN- oder miniDAWN-MALS-Detektor integriert wird, um gleichzeitige DLS-Messungen im selben Streuvolumen zu ermöglichen.
DynaPro® NanoStar® II - Mit einem Probenvolumen von nur 2 µL und einer Temperaturregelung von -10 °C bis +120 °C geht der NanoStar weit über herkömmliche küvettenbasierte DLS-Geräte hinaus: Es bietet einen optimierten Statischen Lichtstreudetektor (parallel zum DLS-Detektionssystem), der mit der CALYPSO-Software verwendet werden kann, um CG-MALS-Experimente mit sehr wenig Probe durchzuführen. Das NanoStar erfüllt eine Doppelfunktion als Online-DLS-Detektor, indem seine optische Sammelfaser in einen Wyatt-MALS-Detektor eingebaut werden kann.
DynaPro® Plate Reader - Das einzige kommerziell erhältliche Gerät, das DLS und SLS, für Größe und molare Masse, direkt in situ in Standard 96-, 384- oder 1536-Mikrotiterplatten misst. Der DynaPro Plate Reader bietet die Möglichkeit mit Robotersystemen kombiniert zu werden und multi-platten-basierte Assay-Protokolle mit mehreren Techniken auszuführen. Der DynaPro Plate Reader bestimmt zusätzlich den zweiten Virialkoeffizienten A2 und den Diffusionsinteraktionsparameter kD. Die Temperatursteuerung liegt im Bereich von 4 °C bis 85 °C.
Brechungsindex-Detektor

Optilab® - Ein einzigartiges Online-Differenzialrefraktometer zur Konzentrationsmessung beliebiger Makromoleküle unabhängig von Chromophoren. Das Hochkonzentrations-Optilab eignet sich für Proteinkonzentrationen bis zu 180 mg/mL.
Software
CALYPSO™ - Die CALYPSO-Software orchestriert die CG-MALS-Analyse biomolekularer Wechselwirkungen und steuert die Probenvorbereitung und Probenzufuhr, die Datenerfassung und die Datenanalyse. Die Software bietet eine umfangreiche Auswahl von Assoziationsmodellen zur Bestimmung der Affinität und der absoluten molekularen Stöchiometrie von makromolekularen Wechselwirkungen, einschließlich Protein-Protein-Interaktionen, Bindung von Aptameren und Peptiden oder Proteinen usw., sowie die Analyse der Reaktionskinetik erster Ordnung.