Partikelkonzentration
Einführung
Die Lichtstreuung misst die Konzentration großer Gruppen von Nanopartikeln und überwindet damit die Beschränkungen von Einzelpartikel-Zählmethoden wie Elektronenmikroskopie, NTA oder TRPS, die Daten mit einer geringen statistischen Relevanz liefern, und eine strenge Probenvorbereitung und Verdünnung auf ein enges Konzentrationsfenster erfordern. Darüber hinaus werden Lichtstreuinstrumente nicht durch größere als die erwarteten Partikel verstopft, und die einzige manuelle Arbeit, die damit verbunden ist, ist in der Regel nur das Pipettieren oder Abfüllen in ein Fläschchen, eine Küvette oder eine Mikrotiterplatte.
Die Lichtstreuungstechniken, die Wyatt für die Konzentrationsanalyse anbietet, basieren auf der Mehrwinkel-Lichtstreuung (MALS) und der dynamischen Lichtstreuung (DLS). Sie bieten einen Kompromiss aus Auflösung, Geschwindigkeit und Probenvolumen, um den Anforderungen von Hochdurchsatz-Screening, detaillierter Charakterisierung oder Echtzeitbetrieb gerecht zu werden.

SEC-MALS und FFF-MALS liefern quantitative und genaue Partikelkonzentrationen und Größenverteilungen. Die Messungen sind mit Autosamplern und Pumpen nach Industriestandard vollständig automatisiert .
Wie Lichtstreuung PC misst
Die Partikelkonzentration (PC) wird aus der Streuintensität, dem Partikelvolumen und den Brechungsindizes nPartikel, nLösungsmittel des Partikelmaterials und des Lösungsmittels berechnet.

- Zusätzlich zur Streuintensität bestimmen sowohl MALS als auch DLS die Partikelgröße, aus der das Volumen der Partikel berechnet wird.
- Die Brechungsindizes werden aus der Literatur entnommen oder aus der Partikelzusammensetzung berechnet, wenn diese nicht homogen ist; der effektive nPartikel des Partikels kann auch gegen eine bekannte Konzentration identischer Partikel kalibriert werden.
Das ist alles, was nötig ist! Weitere Einzelheiten finden Sie auf den Seiten zur MALS-Theorie und zur DLS-Theorie pages.
Anwendungen
Aufgrund des Größenbereichs, der praktischen Anwendung und der Automatisierung von MALS und DLS eignen sie sich gut für die Bestimmung der Konzentration und die Charakterisierung der quantitativen Partikelgrößenverteilung von Nanomedikamenten und technisch hergestellten Nanopartikeln wie z. B.:
- Viren und virale Vektoren
- Lipid-Nanopartikel und Liposomen
- Polymersomen, PLGA-Nanopartikeln
- Nanobeads für die Bioprozessierung und Nanokäfige
- derivatisierte Gold-Nanopartikel
Diese Techniken können in der Forschung und Entwicklung, der Produkt- und Verfahrensentwicklung, der Produktion und Qualitätskontrolle in Standardlabors oder GMP-Umgebungen eingesetzt werden.

Der DynaPro Plate Reader misst die Partikelgröße und -konzentration in standardmäßigen 96er, 384er oder 1536er Mikrotiterplatten mit flachem Boden.
Methoden
SEC/FFF-MALS
MALS wird in den meisten Fällen nach einem größenbasierten Trennverfahren wie der Größenausschlusschromatographie (SEC-MALS) oder der Feldflussfraktionierung (FFF-MALS) eingesetzt. Die Trennung vor der Messung ermöglicht hochauflösende Partikelgrößenverteilungen über einen Größenbereich von 13 nm bis 650 nm Radius (entspricht einem rms-Radiusbereich von 10 nm bis 500 nm), wobei die Auflösung hauptsächlich durch die Trennmethode begrenzt wird.
Da jede Größenfraktion einzeln gemessen wird, wird der Detektor nicht durch starke Streuung von großen Partikeln für kleine Partikel „geblendet“, so dass die Konzentrationswerte im Allgemeinen recht genau sind. Wenn Partikel aus verschiedenen Materialien getrennt werden, kann jedem Peak ein entsprechender nPartikel-Wert zugeordnet werden. Bei SEC-MALS wird ein Standard-HPLC-System mit einem DAWN™ MALS-Gerät verwendet; bei FFF-MALS kommen ein Eclipse™ FFF-Controller und ein Trennkanal hinzu. Die ASTRA™-Software analysiert die Partikelgröße und -konzentration in jeder Elutionsfraktion und kann Peaks integrieren, um die Gesamtzahl der injizierten Partikel in jedem Größenbereich zu berechnen. ASTRA unterstützt die Einhaltung von „21 CFR Part 11“- Konformität, ebenso wie die VISION™ FFF-Software.
Zusätzlich zu Größe und Konzentration kann ein Setup mit UV-, Fluoreszenz- und/oder Brechungsindexdetektoren konfiguriert werden, um die molare Masse, Zusammensetzung und Nutzlast vieler Arten von Nanopartikeln zu bestimmen.
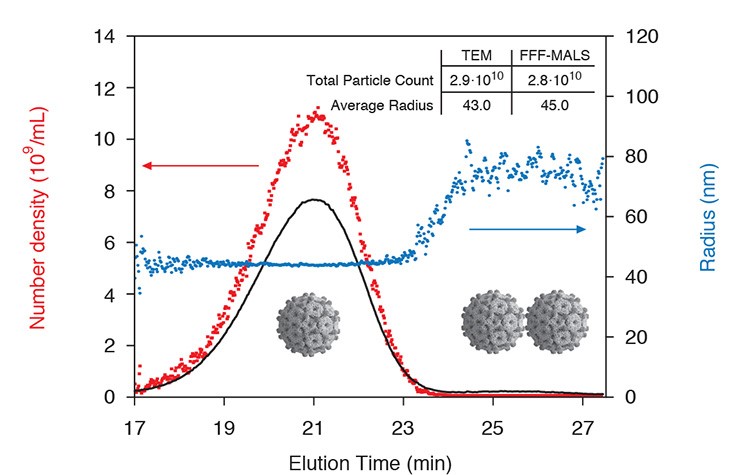
FFF-MALS ist ein hervorragendes Instrument zur Charakterisierung von Impfstoffen. Die Gesamtzahl und Größe der Viren kann mit hoher Auflösung für jede Subpopulation quantifiziert werden.
MALS für PAT
Echtzeit-MALS-Messungen (RT-MALS) der Konzentration werden im Allgemeinen ohne Trennung durchgeführt, um eine schnelle Rückmeldung für prozessanalytische Anwendungen (PAT) zu ermöglichen, wobei die Ergebnisse 30 Mal pro Minute geliefert werden. Die Werte können integriert werden, um den endgültigen Titer von z. B. Viren in den gepoolten Fraktionen zu berechnen. Gleichzeitig wird die Größe kontinuierlich bestimmt, um sie als Kriterium für das Pooling von Biologika-DSP zu verwenden oder um Abweichungen von synthetischen Nanopartikeln im Verlauf der Herstellung zu überwachen.
Das ultraDAWN™ RT-MALS-Gerät wird in der Regel inline mit Produktions- oder Reinigungssystemen verbunden, die mit niedrigeren Flussraten arbeiten. Bei statischen Reaktoren oder Prozessen mit hohen Durchflussraten wird es online konfiguriert, wobei eine Pumpe einen Teil des Produkts ansaugt und es durch das ultraDAWN laufen lässt. Die OBSERVER™-Software steuert den gesamten Prozess; vordefinierte Auslösebedingungen können so eingestellt werden, dass der Bediener bei Erreichen eines Endpunkts oder bei Abweichung von akzeptablen Produkteigenschaften alarmiert wird.
RT-MALS bestimmt nur die Durchschnittsgröße und nicht die gesamte Verteilung. Ist die Größenverteilung also breit, sind die Werte der Partikelkonzentration möglicherweise nicht genau. Die angegebene Konzentration ist am zuverlässigsten für eng dispergierte Nanopartikel.
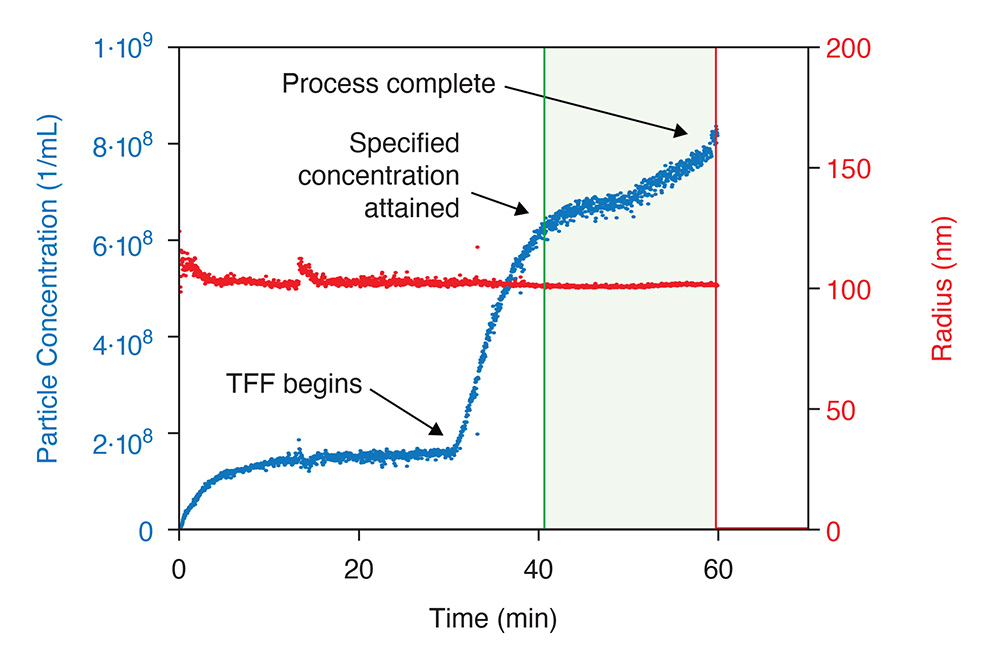
RT-MALS überwacht die Partikelkonzentration im Verlauf der Tangentialflussfiltration. Bei Erreichen des festgelegten Endpunkts wird ein Trigger ausgelöst. Der ultraDAWN misst gleichzeitig die Partikelgröße, um den Virenabbau zu beurteilen.
DLS
DLS wird in der Regel ohne Trennung in Mikroküvetten oder Mikrotiterplatten durchgeführt. Dieser "Batch"-Modus ermöglicht schnelle Messungen von Verteilungen mit relativ geringer Auflösung, wobei die Genauigkeit geringer ist als bei SEC-MALS oder FFF-MALS, aber potenziell höher als bei RT-MALS. Hochdurchsatz-DLS in Mikrotiterplatten ist ideal für die Analyse von viralen Vektor-Downstream-Bioprozessfraktionen oder einer Nanopartikel-Formulierungsmatrix.
Der Größenbereich (hydrodynamischer Radius), in dem die Konzentration gemessen werden kann, liegt beim DynaPro™ Plate Reader bei 0,5 nm bis 160 nm und beim DynaPro™ NanoStar™ bei 0,2 nm bis 175 nm und ist damit für die meisten Viren und Nanomedikamente sowie andere Arten von Nanopartikeln geeignet. Wenn mehr als eine Größenpopulation in der Verteilung zu sehen ist, liefert die DYNAMICS™-Software die Konzentration jeder einzelnen.
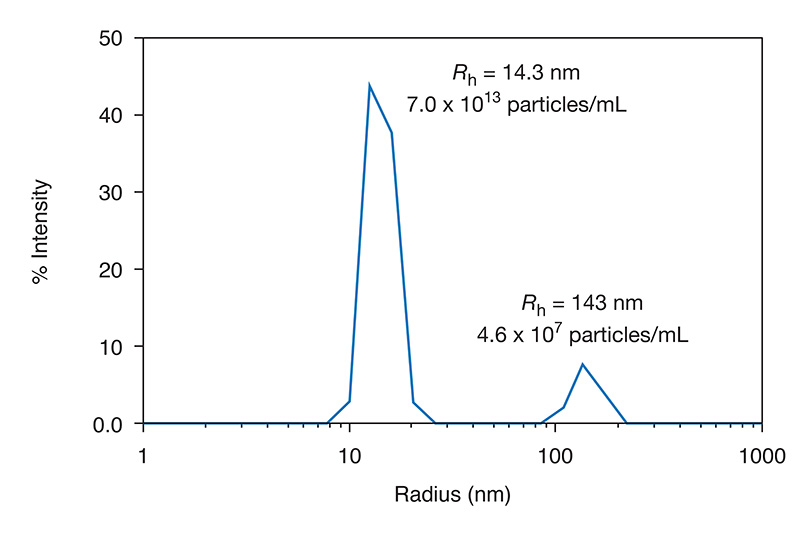
Durch DLS erhaltene Größenverteilung, die die mittlere Größe zweier Populationen und die jeweilige Konzentration zeigt.
Die DLS-Instrumente von Wyatt minimieren den Probenbedarf drastisch. In Einwegküvetten werden nur 2 µl Probe benötigt, und in den gebräuchlichsten 384-Well-Platten sind für optimale Messungen 20 µl - 35 µl erforderlich. Obwohl diese Geräte mehrere Größenordnungen an Konzentration abdecken, ist es bei hohen Partikelkonzentrationen und notwendiger Verdünnung einfach, dies direkt im Messvolumen zu tun.
DLS in QC und at-line PAT
DLS ist besonders nützlich für die schnelle und einfache Analyse von Nanopartikeln mit minimaler Gerätekomplexität oder minimalem Aufwand für die Probenvorbereitung. Die DLS-Geräte von Wyatt werden von der DYNAMICS™-Software unterstützt, einer umfassenden Suite für Gerätesteuerung, Datenerfassung und Analyse, die eine umfassende Automatisierung, umfangreiche Charakterisierungsfunktionen und intuitive Rückmeldungen zur Qualität und Zuverlässigkeit jeder einzelnen Messung bietet.
Für den Einsatz in der Qualitätskontrolle und in der Prozessanalytik bietet DYNAMICS die Einhaltung von 21 CFR Part 11. Darüber hinaus unterstützt es eine Anwendungsprogrammierschnittstelle (API), die die Integration mit Flüssigkeitsmanipulatoren von Drittanbietern und hochentwickelter Prozess- oder Qualitätskontrollsoftware ermöglicht.

Ressourcen
Ausgewählte Literatur
Improved multidetector-asymmetrical flow field flow fractionation method for particle sizing and concentration measurements of lipid-based nanocarriers for RNA delivery, Mildner, R. et al. Eu. J. Pharm. Biopharm. 163, 252-265 (2021) https://doi.org/10.1016/j.ejpb.2021.03.004
Biophysical characterization of influenza virus subpopulations using field flow fractionation and multiangle light scattering: correlation of particle counts, size distribution and infectivity, Wei, Z. et al J. Virolog. Meth. 144(1-2), 122-132 (2007). https://doi.org/10.1016/j.jviromet.2007.04.008
Quantitation of influenza virus using field-flow fractionation and multi-angle light scattering for quantifying influenza A particles, Bousse, T. et al. J. Virolog. Meth. 193(2), 589-596 (2013). https://doi.org/10.1016/j.jviromet.2013.07.026
Quantification and characterization of virus-like particles by size-exclusion chromatography and nanoparticle tracking analysis, Steppert, P. et al. J. Chromat. A 1487, 89-99 (2017) http://dx.doi.org/10.1016/j.chroma.2016.12.085