Lichtstreuung – Arten, Funktionsweise & Verwendung

Inhaltsverzeichnis:
- Lichtstreuung einfach erklärt
- Wie funktioniert Lichtstreuung?
- Welche Arten von Lichtstreuung gibt es?
- Was ist der Unterschied zwischen dynamischer und statischer Lichtstreuung?
- Wie hängen in der statischen Lichtstreuung Partikelgröße und Streuwinkel zusammen?
- Wofür eignet sich die Lichtstreuung?
- Lichtstreuung analytisch nutzen mit hochwertiger Labortechnik von Waters | Wyatt
Lichtstreuung einfach erklärt
Lichtstreuung ist gemäß Definition das Ergebnis der Interaktion von Licht mit Materieteilchen. Wohin und in welcher Intensität das Licht gestreut wird, richtet sich nach seiner Wellenlänge und dem Durchmesser der Teilchen, mit denen es in Wechselwirkung tritt. Daher setzt sich der Vorgang der Lichtstreuung stets aus einer Absorption (die Materie absorbiert Photonen) und einer Emission (die Materie gibt die Photonen wieder frei) zusammen.Welche Arten von Lichtstreuung gibt es?
Zu den wichtigsten Arten zählen die elastische und die inelastische Lichtstreuung. Ist die Energie des emittierten Photons gleich der des zuvor absorbierten, handelt es sich um elastische Lichtstreuung. Beispiele hierfür sind die Mie-Streuung und die Rayleigh-Streuung. Beide kommen sehr oft in der Analytik zur Anwendung, erstere z. B. an Flüssigkeitströpfchen, letztere an Atomen und Molekülen.Ist die Energie des emittierten Photons ungleich der des absorbierten, liegt eine inelastische Lichtstreuung vor. Das ist beispielsweise bei der Raman-Streuung der Fall, auf der die Raman-Spektroskopie beruht.
Die Mie-Streuung entsteht, wenn das Licht mit Teilchen interagiert, die in etwa so groß sind wie die Wellenlänge der Lichtstrahlen. Hierbei werden die einfallenden Wellenlängen gleichmäßig gestreut.
Zur Rayleigh-Streuung kommt es, wenn der Durchmesser der vom Licht bestrahlten Teilchen wesentlich kleiner ist als die Wellenlänge des Lichts. Dadurch ist die Rayleigh-Streuung deutlich schwächer als die Mie-Streuung.
Wird ein Teil der Energie eingestrahlter Photonen auf die Materie übertragen, liegt die Raman-Streuung vor. Das streuende Teilchen gelangt dadurch auf ein höheres Energieniveau, während sich die Energie und die Frequenz der Photonen verringern.
Was ist der Unterschied zwischen dynamischer und statischer Lichtstreuung?
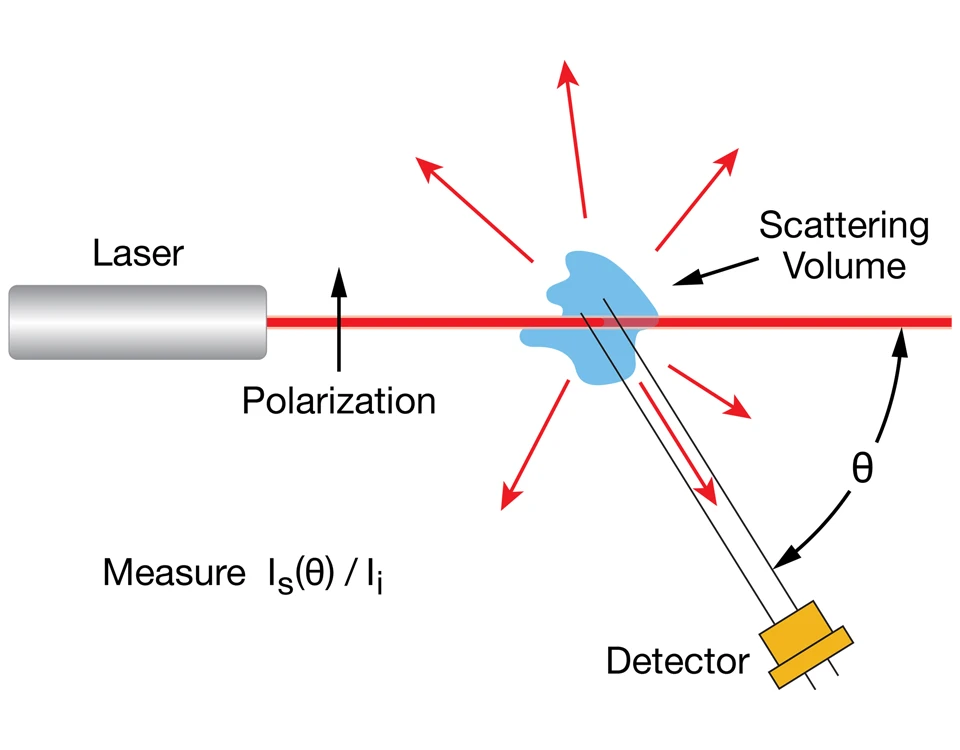
Streulicht-Verfahren zur Charakterisierung von Proteinen, Polymeren, Biopolymeren und Nanopartikeln haben sich in vielen Branchen und Industrien etabliert. Dabei kommen entweder die statische Lichtstreuung (SLS) oder die dynamische Lichtstreuung (DLS) zur Anwendung. Beide Techniken sind vom apparativen Aufbau her ähnlich. Der wesentliche Unterschied besteht in der Verarbeitung der Messdaten.Sowohl bei der dynamischen als auch bei der statischen Lichtstreuung werden die Polymere oder andere Probenmaterialien mit einem Laserstrahl beleuchtet. Dann wird das von der Probe gestreute Licht in einem oder in mehreren Winkeln über Messdioden erfasst. Um auch Streulicht geringer Intensität aufzeichnen zu können, werden hierfür häufig hochempfindliche Avalanche-Photodioden (APD) genutzt, die lichtverstärkend wirken.
Im Fall der statischen Lichtstreuung werden eher wenige Messdaten erfasst (üblicherweise fünf bis zehn pro Sekunde), die direkt über eine Zeitachse dargestellt werden. Bei der dynamischen Streuung erfolgt die Aufzeichnung im Mikrosekundenbereich. Aus den gewonnenen Daten wird eine mathematische Korrelationsfunktion berechnet. Weisen alle Probenbestandteile die gleiche Größe auf, ergibt sich ein exponentieller Funktionskurvenverlauf erster Ordnung. Je schneller die Korrelationsfunktion auf null absinkt, desto kleiner ist der Durchmesser der Probenmoleküle.
Enthält die Probe Partikel oder Moleküle unterschiedlicher Größen, setzt sich die Korrelationsfunktion aus einer Vielzahl von Exponentialfunktionen zusammen. Jede davon entspricht einer Partikel- oder Molekülgröße. Um die komplexe Korrelationsfunktion bestmöglich beschreiben zu können, wird der beste Satz einzelner Exponentialfunktionen mithilfe eines Regularisierungsalgorithmus bestimmt. Aus den individuell berechneten Exponentialfunktionen lässt sich dann die Größenverteilung der in der Probe enthaltenen Partikel oder Moleküle abschätzen.
Instrumente für die statische Lichtstreuung werden mithilfe eines Standards mit bekanntem Rayleigh-Streulichtverhältnis oder bekanntem Molekulargewicht kalibriert. Meist dienen eng verteilte Protein-, Polymer- und Biopolymerstandards oder Toluol als Kalibrierstandards. Um das Molekulargewicht einer Probe aus der Fläche des Streulichtsignals bestimmen zu können, müssen sowohl die Konzentration als auch das Brechungsindexinkrement der Probe bekannt sein.
Ein wesentlicher Vorteil der dynamischen Lichtstreuung besteht darin, dass es zum Bestimmen der Molekül- und Partikelgrößen keiner Informationen über die Probe bedarf. Bekannt sein müssen lediglich die Viskosität und der Brechungsindex des verwendeten Dispergier- oder Lösungsmittels. Auch ist bei DLS-Instrumenten keine Kalibrierung erforderlich.
Wie hängen in der statischen Lichtstreuung Partikelgröße und Streuwinkel zusammen?
Bei der statischen Lichtstreuung ist die Partikelgröße deshalb von Bedeutung, weil die Lichtwellen von den Partikeln abhängig von ihrer Größe in spezifischer Art und Weise gestreut werden. Je größer die Teilchen sind, umso stärker erfolgt die Streuung in Vorwärtsrichtung.Bei größeren Partikeln hat das Streulicht eine Ringstruktur, die sich in erster Linie durch die Beugung erklären lässt. Mit zunehmender Teilchengröße werden die Beugungswinkel kleiner, wodurch die Ringe näher am Zentrum liegen. Zudem steigt die Intensität der Beugungsmaxima.
Fällt das Licht auf Partikel, entsteht eine diffuse Lichtstreuung, wobei ab einer Größe von etwa 10 nm (wellenlängenabhängig) mehr Licht nach vorn als nach hinten oder zur Seite gestreut wird. Mit abnehmender Teilchengröße sinkt die Gesamtintensität des Streulichts und es wird mehr zur Seite und weniger nach vorn gestreut. Um die schwachen Streulichtsignale sehr kleiner Partikel auswerten zu können, wird die statische Streulichtmessung mit geringeren Wellenlängen ausgeführt, woraus generell stärkere Signale resultieren.
Enthält eine Probe Partikel unterschiedlicher Größen, überlagern sich die Streulichtmuster. Der Einfluss der verschiedenen Teilchengrößen ist entsprechend bei der Auswertung und Berechnung der Partikelgrößenverteilung zu berücksichtigen.
Wofür eignet sich die Lichtstreuung?
Die SLS ist sowohl in der Polymerchemie als auch in der Nanotechnologie und der Pharmazie weit verbreitet. Sehr häufig wird sie als Durchflusstechnik mit MALS-Detektoren eingesetzt, aber auch im Batch-Modus mit sogenannten Goniometer-Systemen.In der Polymerchemie werden mithilfe von MALS absolute Molekulargewichte von Polymerproben sowie deren Trägheitsradien in Lösung ermittelt. Im pharmazeutischen Bereich erfüllt die SEC-MALS-Technologie einen ähnlichen Zweck. Eine wesentliche Aufgabe besteht dabei im Überprüfen biologischer Proben wie Proteinen auf das Vorhandensein hochmolekularer Proteinaggregate.
Auf dem Gebiet der Nanotechnologie dienen MALS-Detektoren zur Bestimmung der absoluten Größen von Nanopartikeln, die vorab mittels Feldflussfraktionierung (FFF) aufgetrennt wurden. Die FFF-MALS-Systeme von Waters | Wyatt stellen eine Kombination aus diesen beiden Technologien dar.
Die dynamische Lichtstreuung kommt sehr oft als Küvettenmethode (Batch-Modus) im pharmazeutischen Bereich zum Einsatz. Damit lässt sich beispielsweise überprüfen, ob ein Antikörper oder ein anderes therapeutisches Protein in Lösung in reiner Form vorliegt oder die Probe zusätzlich einen geringen Anteil an hochmolekularen Aggregaten enthält, die die Verträglichkeit und/oder die Wirksamkeit des Pharmazeutikums beeinträchtigen könnten. Darüber hinaus hat sich die DLS als Standardmethode zur Größenbestimmung von Nanopartikeln aller Art etabliert.
Auch die Anwendung als Durchflussdetektor in der Feldflussfraktionierung oder der Chromatographie ist möglich. Aufgrund der relativ langen Messzeiten ist dieses Vorgehen aber nur bei sehr geringen Durchflussraten sinnvoll.
Lichtstreuung analytisch nutzen mit hochwertiger Labortechnik von Waters | Wyatt
Wollen Sie mithilfe der Lichtstreuung Eigenschaften von Polymeren und anderen Materialien in Mikro- und Nanopartikel-Größe schnell, einfach und zerstörungsfrei ermitteln, ist Waters | Wyatt der richtige Ansprechpartner. Unsere Analysetechnik gewährleistet höchste Präzision und schafft damit optimale Voraussetzungen für exakte Ergebnisse.Sie haben Fragen oder wünschen sich ausführlichere Informationen zu unseren Methoden rund um die Lichtstreuung?
Dann kontaktieren Sie uns am besten gleich für eine individuelle Beratung durch unsere Spezialisten.
Weitere Fragen und Antworten zu Lichtstreuung
Was versteht man unter Lichtstreuung?
Lichtstreuung ist das Ergebnis der Interaktion von Licht mit Materieteilchen. Wohin und in welcher Intensität das Licht gestreut wird, richtet sich nach seiner Wellenlänge und dem Durchmesser der Teilchen, mit denen es in Wechselwirkung tritt.
Wie wird das Licht gestreut?
Ist die Energie des emittierten Photons gleich der des zuvor absorbierten, handelt es sich um elastische Lichtstreuung. Beispiel hierfür ist die Mie-Streuung, welche entsteht, wenn das Licht mit Teilchen interagiert, die in etwa so groß sind wie die Wellenlänge der Lichtstrahlen.
Wofür wird die Lichtstreuung verwendet?
- In der Polymerchemie, um absolute Molekulargewichte von Polymerproben sowie deren Trägheitsradien in Lösung zu ermitteln.
- In der Nanotechnologie, zur Bestimmung der absoluten Größen von Nanopartikeln.
- In der Pharmazie, um bspw. zu prüfen, ob ein Antikörper oder ein anderes therapeutisches Protein in Lösung in reiner Form vorliegt.
