
Absolute Messwerte erhalten
Mit unseren DAWN® Mehrwinkel-Lichtstreuungsgeräten (MALS) können Sie absolute Molekulargewichte und -größen bestimmen, ohne sich auf so genannte Standards oder Messungen in einem fremden Labor zu verlassen. Wyatt-Geräte messen alle Größen, die für die Bestimmung absoluter molarer Massen erforderlich sind, direkt.

DAWN®
Der empfindlichste MALS-Detektor, der auf dem Markt erhältlich ist. Beinhaltet Detektoren auf 18 Winkeln zur Bestimmung der molaren Masse von 200 Da bis 1 GDa und Radien von 10 bis 500 nm.
Nicht vermuten, Messen
Während es viele Möglichkeiten gibt, molare Massen oder Molekulargewichte von Makromolekülen wie Proteinen, Biopolymeren und synthetischen Polymeren zu bestimmen, gibt es nur eine, die die absoluten Molekulargewichte in Lösung, schnell und effektiv ermittelt: Die statische Mehrwinkel-Lichtstreuung (MALS). MALS kombiniert präzise Messungen der Lichtstreuintensität und der Konzentrationen für eine kompromisslos eindeutige Berechnung der molaren Massen in Lösung aus Daten, die direkt gemessen werden, ohne Annahmen der Konformation oder Form und ohne Störungen der Probe.
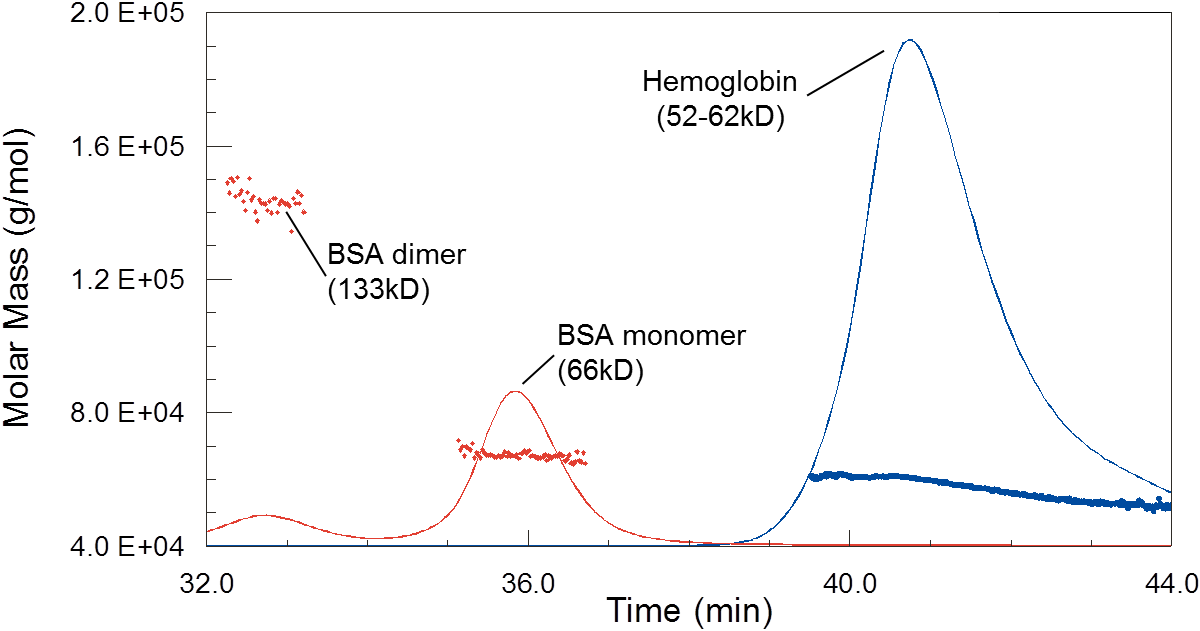
Während die Säulenkalibrierung nahelegen würde, dass Hämoglobin viel kleiner als BSA ist, zeigt MALS, dass sie tatsächlich ähnliche Molmassen haben. Die Polydispersität von Hämoglobin, hier zu sehen als nachlaufende Schulter am Peak mit abnehmendem Molekulargewicht, ist auf ein dynamisches Gleichgewicht zwischen Monomeren, Dimeren und Tetrameren zurückzuführen.
Identifikation
Die molare Masse ist der Schlüssel zur Identifizierung von Proteinen, ihren Oligomeren oder Komplexen. Dennoch verlassen sich allzu viele Proteinforscher auf eine vereinfachte, ungültige Analyse des Molekulargewichts durch SDS-PAGE oder traditionelle Größenausschlusschromatographie (SEC). Diese Techniken berufen sich auf Annahmen zur Konformation und zu idealen Matrixinteraktionen, die Wissenschaftler mit zweideutigen oder völlig falschen Ergebnissen täuschen können, was zu einer grundlegend ungenauen Interpretation ihrer Daten für wissenschaftliche Publikationen führt.
Die Mehrwinkel-Lichtstreuung gekoppelt mit SEC (SEC-MALS) ermöglicht eine genaue Molekulargewichtsbestimmung von Proteinen, Oligomeren und Komplexen, unabhängig von Konformation oder nicht-idealen Säulenwechselwirkungen. Das liegt daran, dass SEC-MALS eine genaue Analyse der molaren Masse nach den ersten Prinzipien darstellt, die nicht auf Retentionszeit oder Kalibrierung mit Referenzmolekülen angewiesen ist. Die einzige Funktion der SEC-Säule ist die Trennung der Moleküle nach Größe, während MALS die molare Masse der eluierenden Proteine unabhängig bestimmt.
Konjugation
Viele interessante und nützliche Makromoleküle bestehen aus zwei chemisch und physikalisch unterschiedlichen Spezies, die kovalent konjugiert sind. Dies kann es recht schwierig machen, die wesentlichen Eigenschaften molarer Masse und Größe durch Größenausschlusschromatographie zu charakterisieren, da keine Kalibrierstandards existieren, die das Elutionsverhalten dieser Komponenten repräsentieren. Oft ist einer oder beide der Hauptbestandteile nicht für die Massenspektrometrie zugänglich.
Die Kombination von Mehrwinkel-Lichtstreuung (MALS), UV- und Brechungsindex-Detektion mit Größenausschlusschromatographie, plus ASTRA®'s Konjugat-Analyse-Algorithmus, bietet die Lösung für die Charakterisierung von konjugierten Makromolekülen wie:
- Block-Copolymere
- Glykoproteine, Lipoproteine und Nanodiscs
- PEGylierte Proteine
- In Detergensmizellen solubilisierte Membranproteine
- Protein-Polysaccharid-Impfstoffe
- Antikörper-Wirkstoff-Konjugate
Konzeptionell kann ein Komplex, der aus einem Protein, das ein UV-Chromophor enthält und einer zweiten Komponente wie Polyethylenglykol oder PEG, das kein UV-Chromophor enthält, besteht, durch die Kombination von Informationen aus zwei verschiedenen Messungen analysiert werden. Die UV-Absorption bestimmt die Proteinkonzentration, während der RI-Detektor die Gesamtkonzentration der Makromoleküle bestimmt. Die Konzentration der zweiten Komponente ist die Differenz zwischen diesen beiden Werten. Eine genaue Berechnung berücksichtigt die Extinktionskoeffizienten und unterschiedlichen Brechungsindizes beider Spezies. Diese beiden Messungen sind ausreichend, um das Verhältnis von Protein und zweite Komponente im Komplex zu bestimmen. Diese Analyse kann jedoch nicht die Gesamtmasse oder den oligomeren Zustand der Spezies bestimmen.
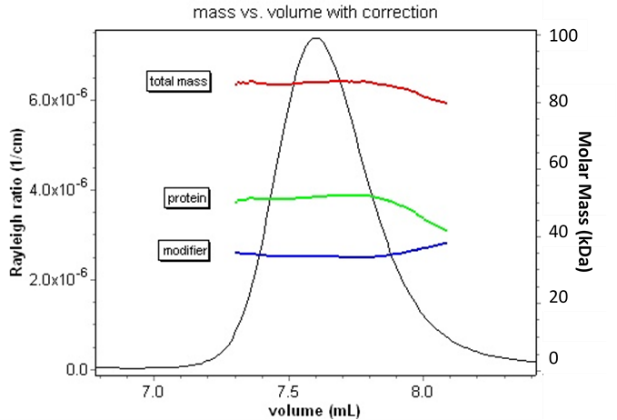
Die Kombination der MALS-UV-RI-Analyse mit der Größenausschlusschromatographie ermöglicht die Analyse von konjugierten Proteinen.
Die Hinzunahme eines MALS-Detektors bietet die Antwort auf die vollständige Charakterisierung der Konjugate. Da die Lichtstreuung proportional zum Produkt aus molarer Masse und Konzentration ist, reicht die Kombination dieser drei Signale aus, um nicht nur das Verhältnis, sondern die tatsächliche molare Masse und damit den oligomeren Zustand jedes Bestandteils zu bestimmen. Diese Information ist entscheidend für die Beurteilung der Aggregation von Konjugaten, die Messung der molaren Masse von Block-Copolymeren oder die Entscheidung, ob ein mit Hilfe eines Detergens in Lösung gebrachtes Membranprotein als natives Oligomer vorliegt oder nicht.
Membranproteine
Mit Detergens solubilisierte Membranproteine sind aufgrund der das Protein umgebenden Tensidmizelle besonders schwierig mit traditionellen Techniken oder sogar mit Massenspektroskopie zu analysieren. Denaturierende SDS-PAGE dissoziiert native Oligomere und schließt deren Identifizierung aus, während die vernetzte Massenspektroskopie Oligomere erzeugen kann, die in Lösung nicht existieren.
Ebenso können stark glykosylierte Proteine nicht durch Referenzstandards oder gängige Modelle für globuläre Proteine dargestellt werden und sind daher für die Analyse mit traditionellen Techniken nicht geeignet.
Diesen Herausforderungen begegnet die mit SEC gekoppelte Mehrwinkel-Lichtstreuung (SEC-MALS), die zwischen einem Protein und seinem assoziierten Detergens oder Kohlenhydrat unterscheiden kann, indem sie Daten von drei Detektoren nach der SEC-Trennung kombiniert: UV, MALS und Differentieller Brechungsindex (dRI). Der ASTRA-Algorithmus für die Konjugatanalyse berechnet die Molmassen sowohl der proteinhaltigen Komponente als auch der konjugierten oder mizellaren Komponente. Der wahre oligomere oder komplexierte Zustand des Proteins sowie der Grad der Glykosylierung werden eindeutig bestimmt.
